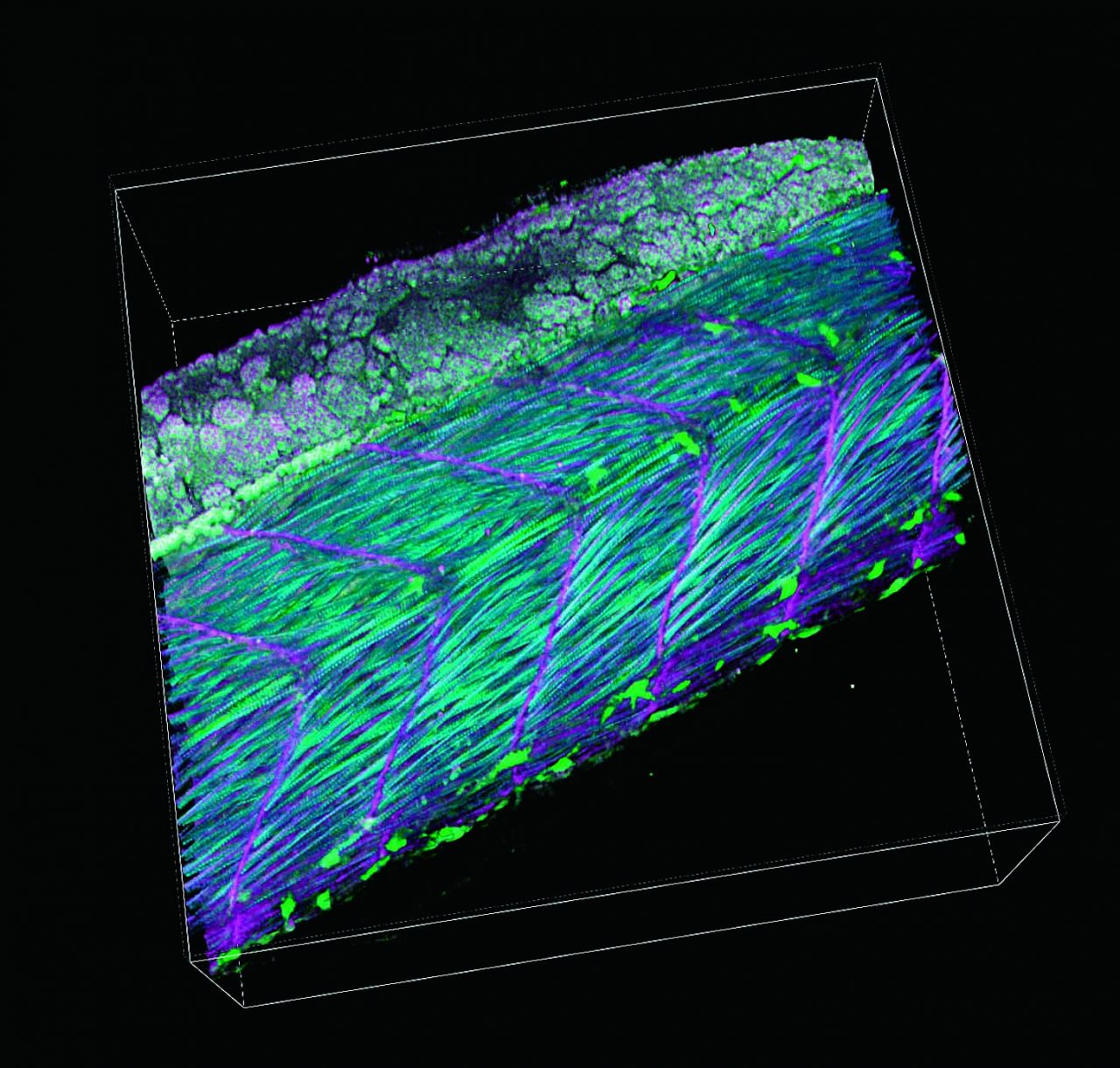
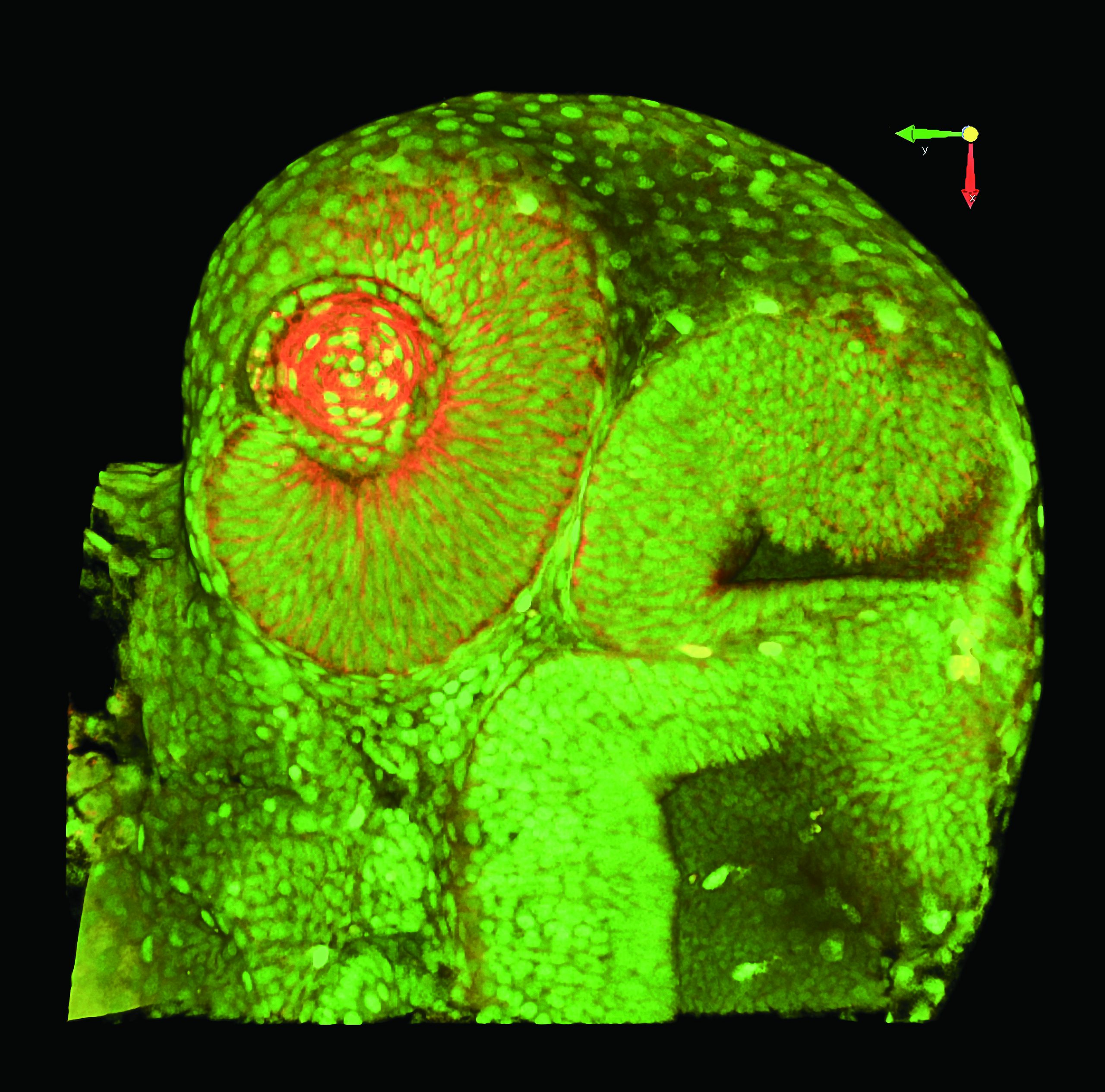
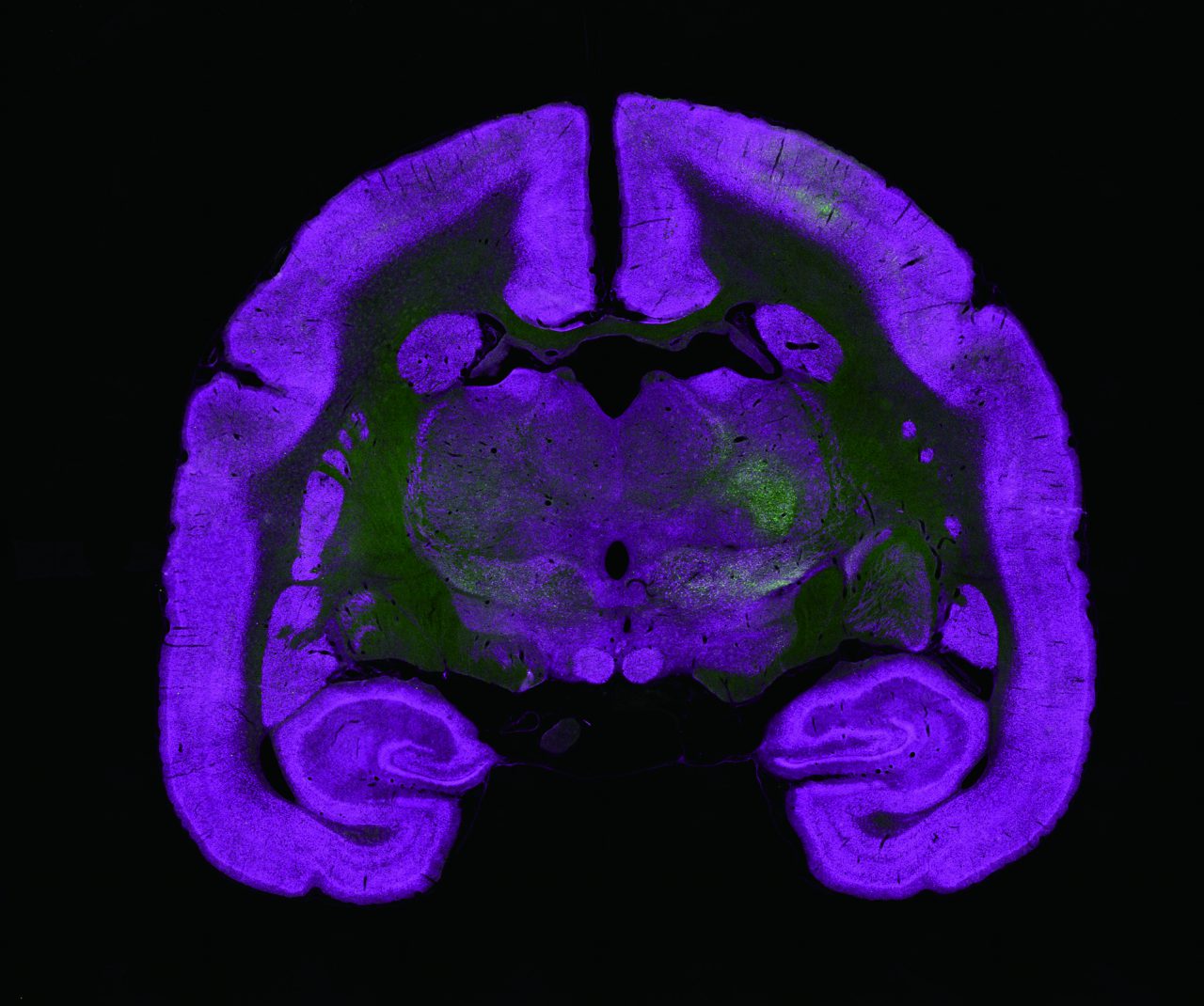
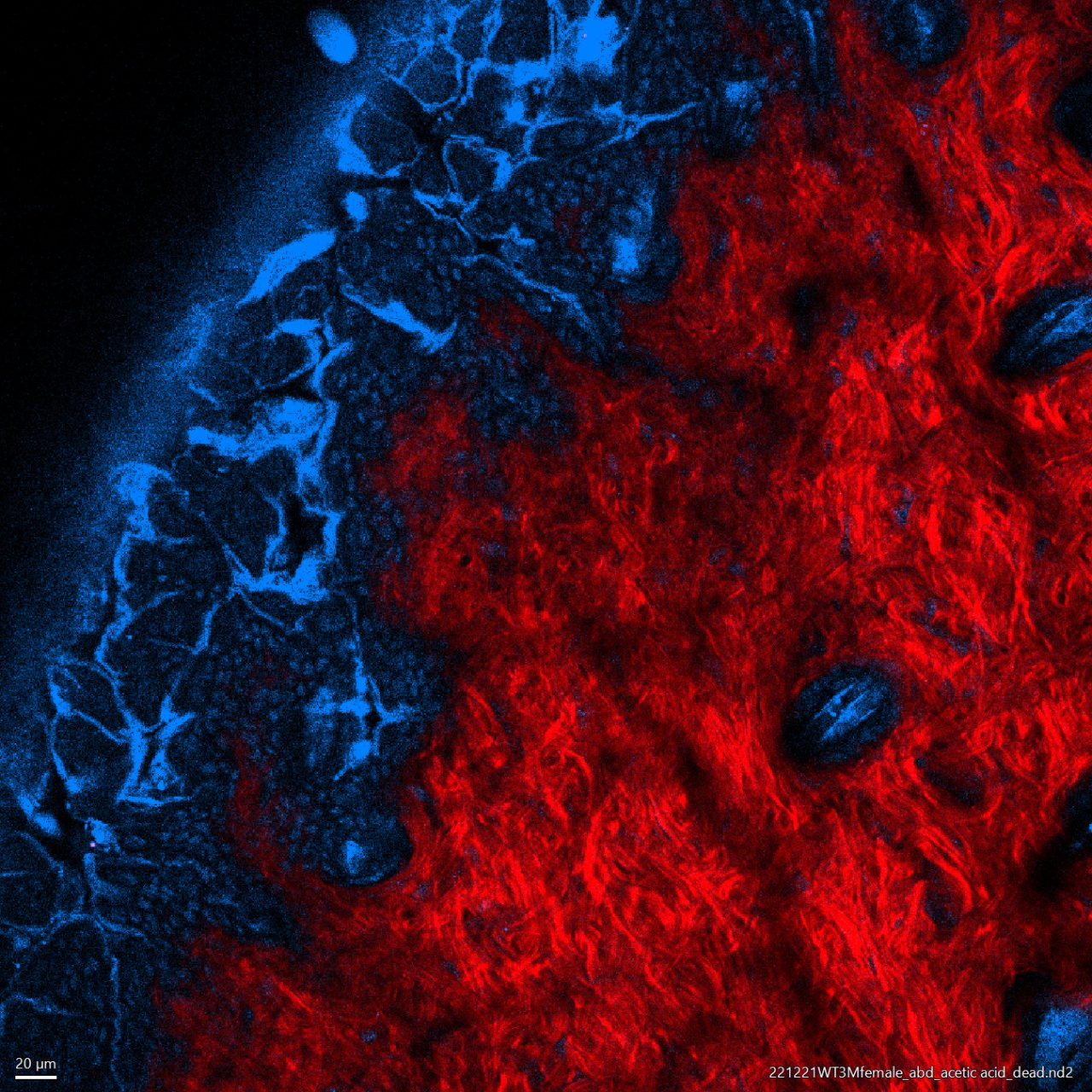
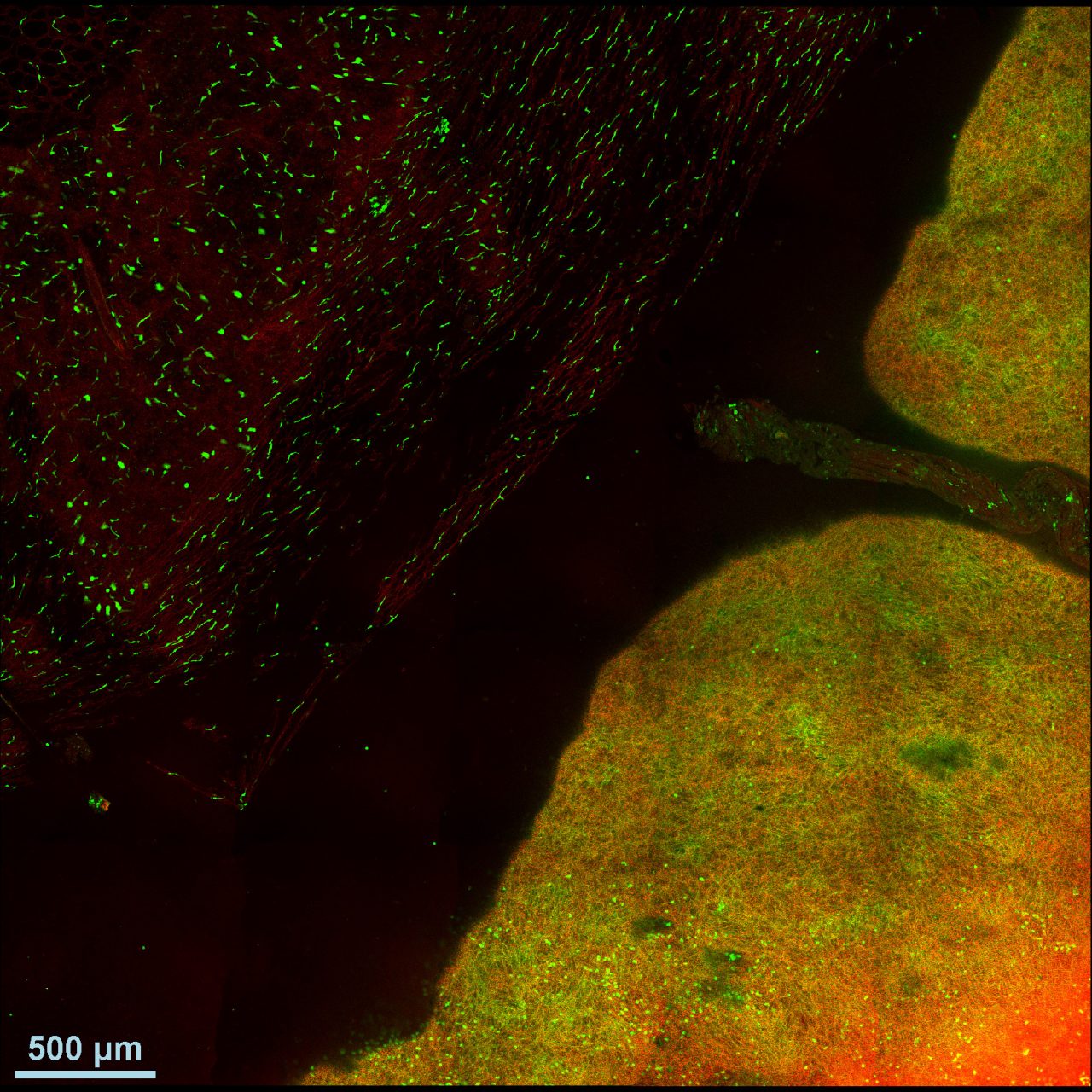
受精後34時間のゼブラフィッシュ・トランスジェニック系統Tg[h2afv:GFP; EF1α: mCherry-CAAX]を用いて体幹を横から見た像。メラニン合成を抑制するフェニルチオ尿素(PTU)下で飼育したゼブラフィッシュの体全体に透明化剤LUCIDを用いて処理を施した。この系統では細胞膜をmCherry(紫色)で、クロマチンをGFP(緑色)で可視化している。
励起波長:900nm (SHG、GFP)、1040nm (mCherry)
対物レンズ:CFI75アポクロマート25xW MP1300 (NA1.10, WD2.0 )
撮影ご協力:沖縄科学技術大学院
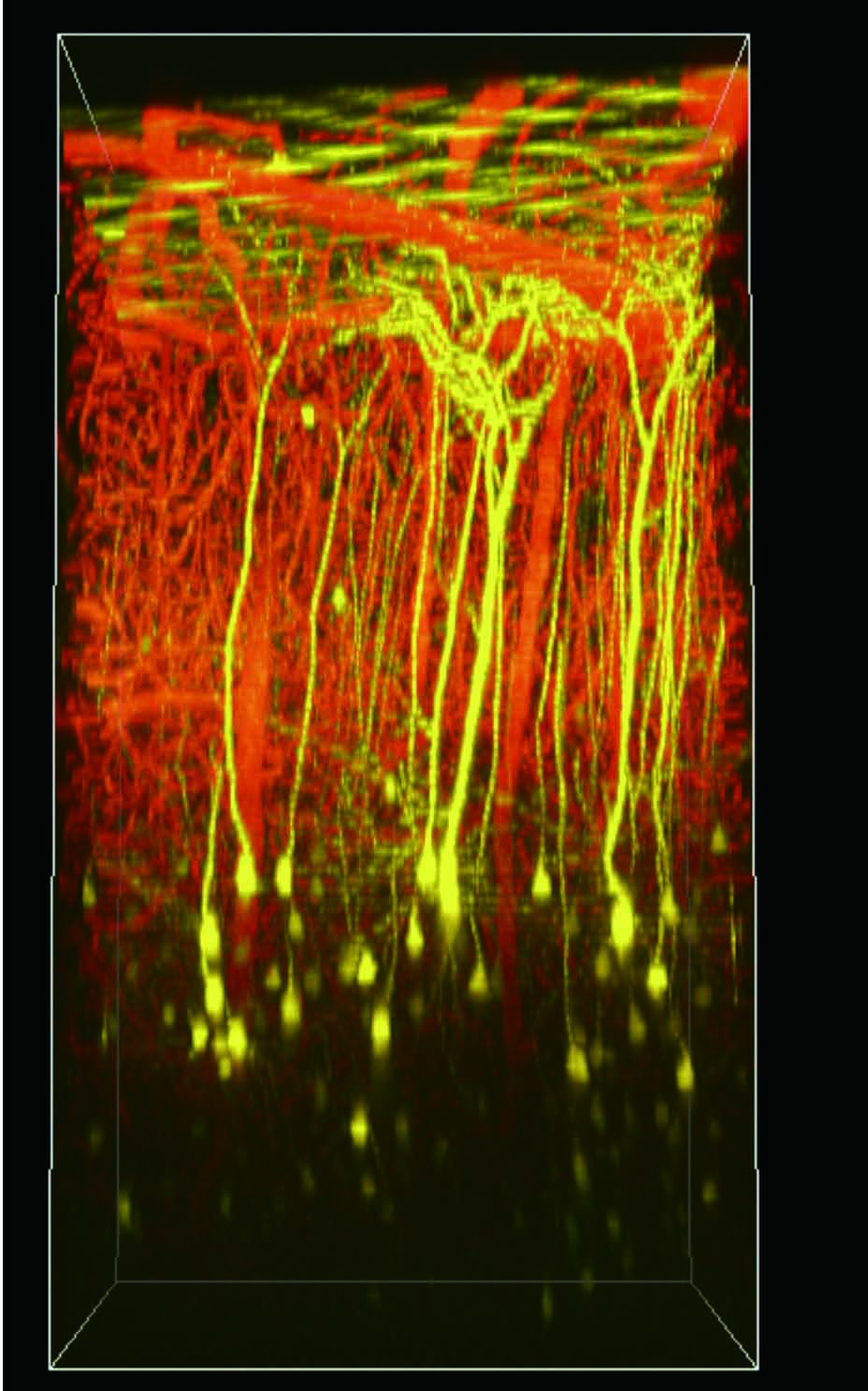
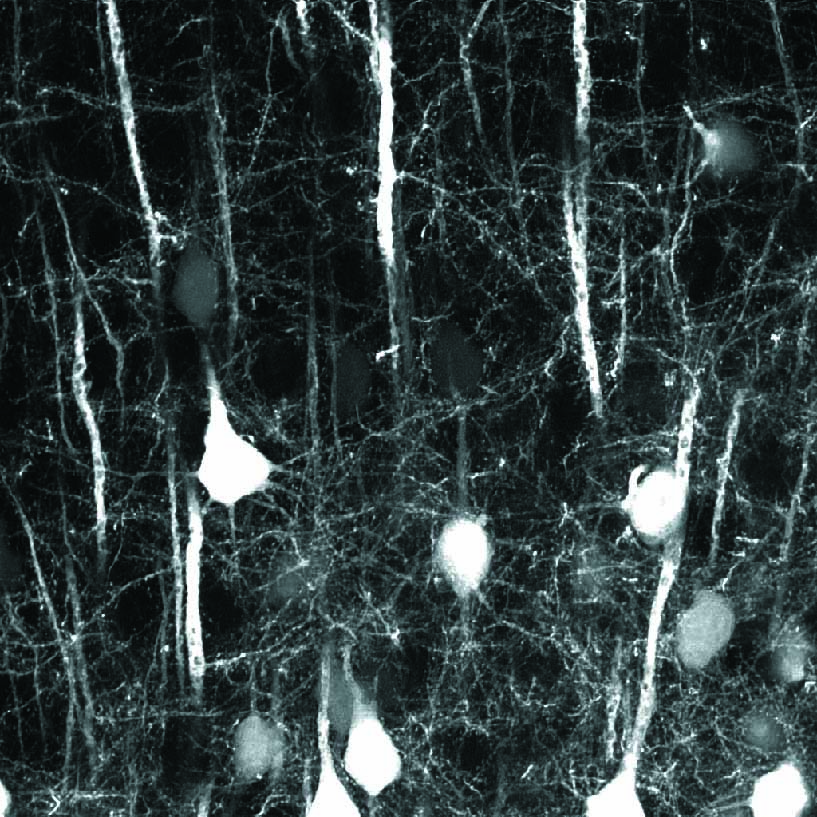
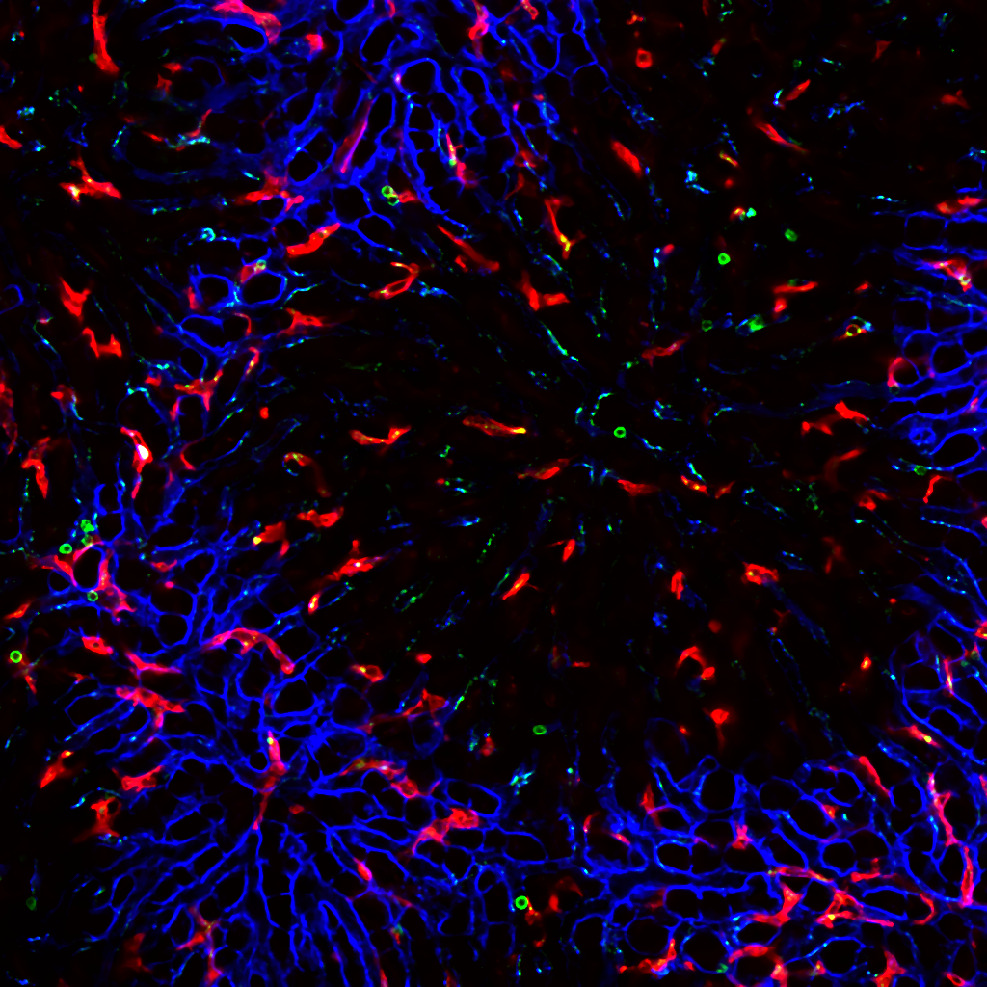
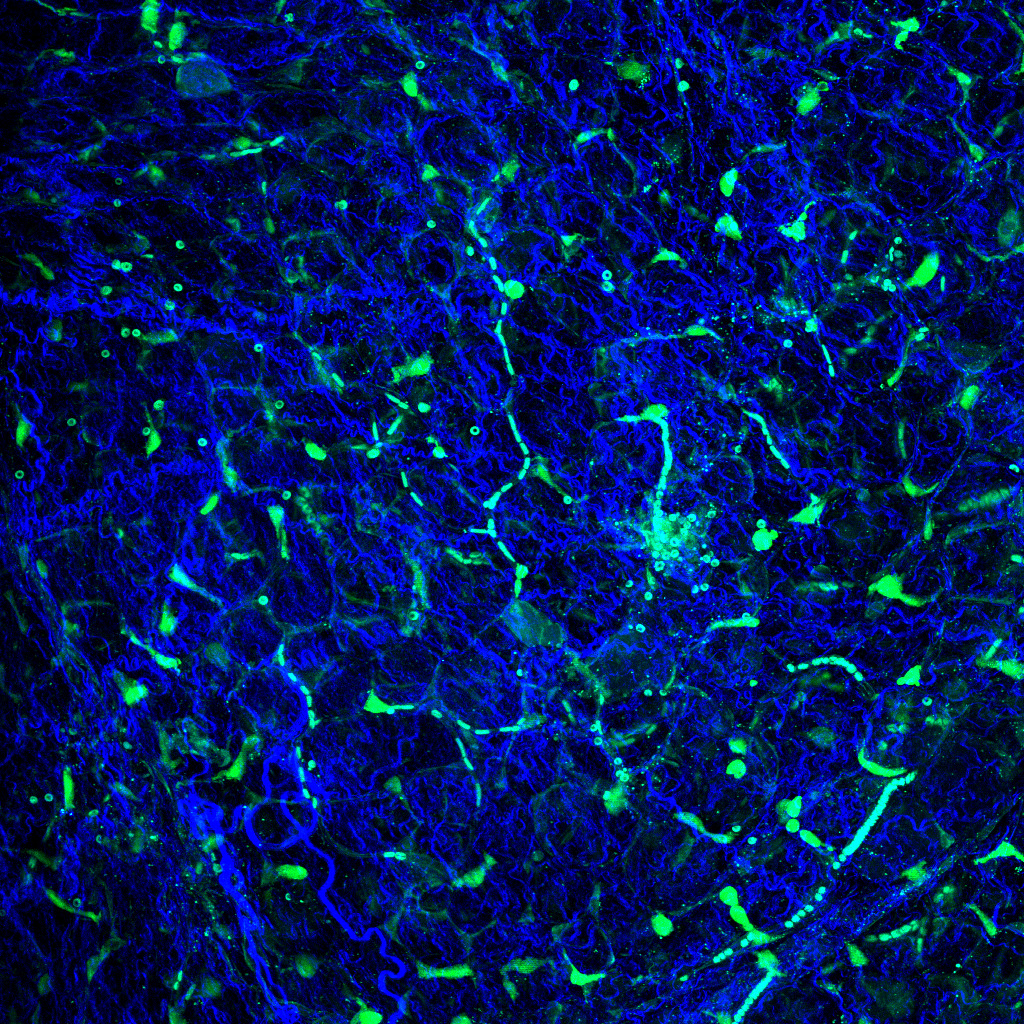
麻酔下のYFP-H マウス(4週齢)にSRB(Sulforhodamine B)を尾静注した後、大脳新皮質をオープンスカル法で観察。レゾナントスキャナーとGaAsP NDD EPI ユニット
を使用し、さまざまなZ 軸面深部における血流の画像を取得。
黄:大脳皮質の第V 層の錐体細胞のEYFP 蛍光シグナル、赤:血液中のSRB蛍光シグナル
撮影ご協力:北海道大学電子科学研究所 光細胞生理研究分野 川上良介先生、日比輝正先生、根本知己先生
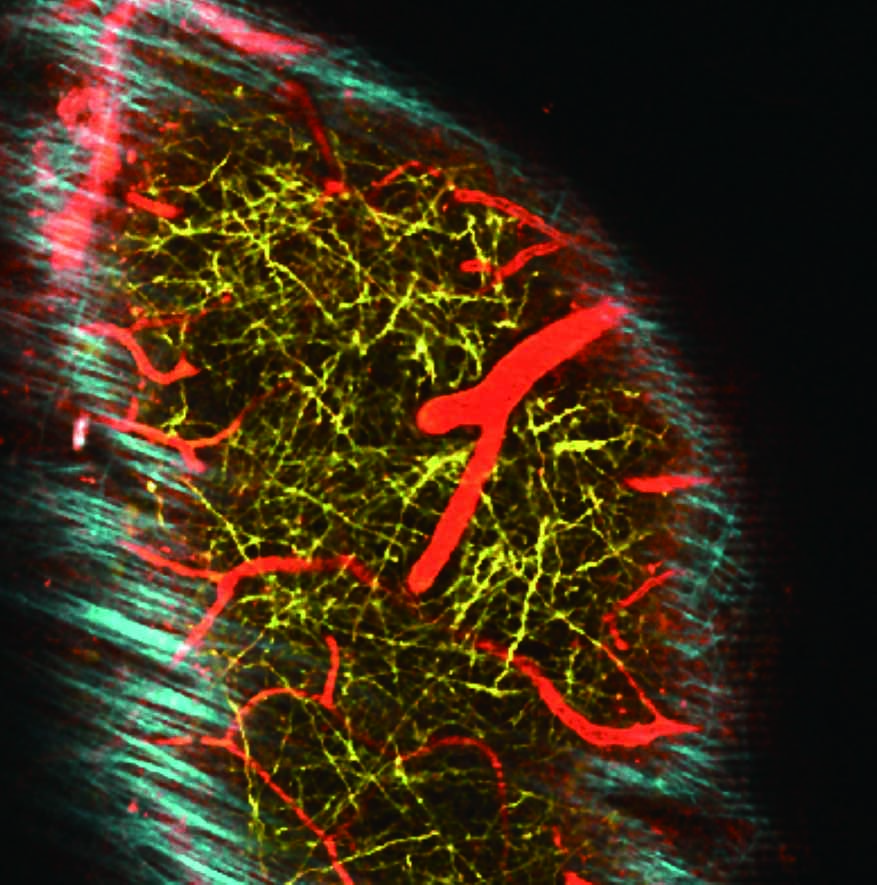
950 nm のIR励起光を用いて、麻酔下のYFP-H マウスの3チャンネル画像を同時取得。
撮影ご協力:北海道大学電子科学研究所 光細胞生理研究分野 川上良介先生、日比輝正先生、根本知己先生
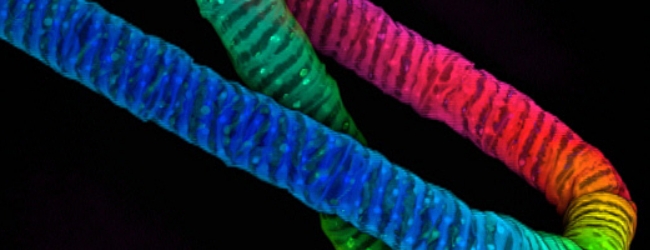
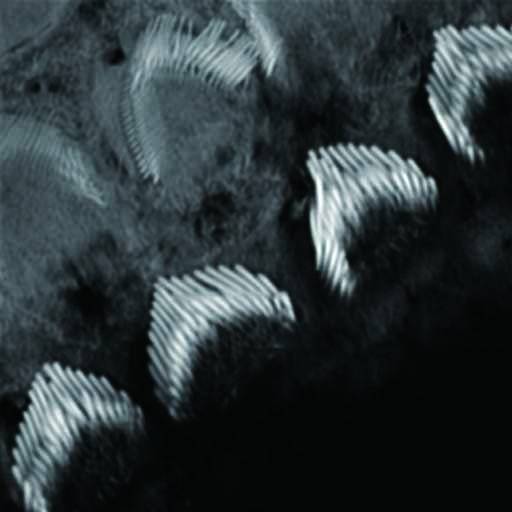
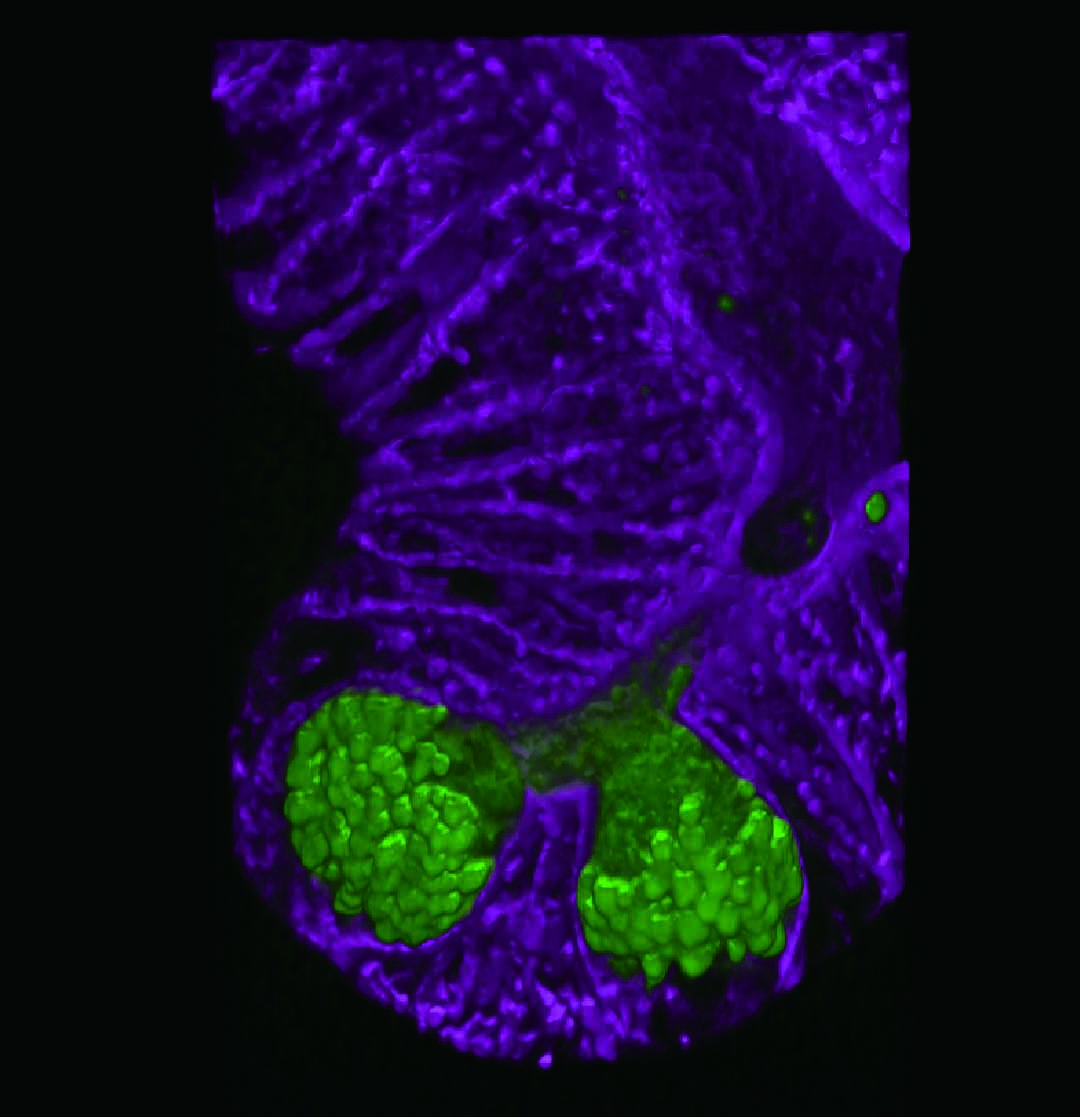
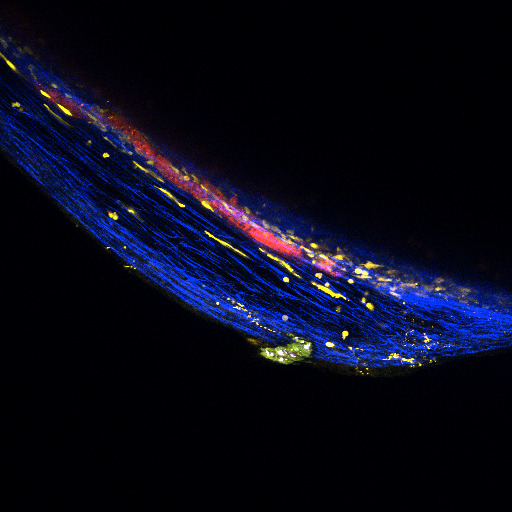
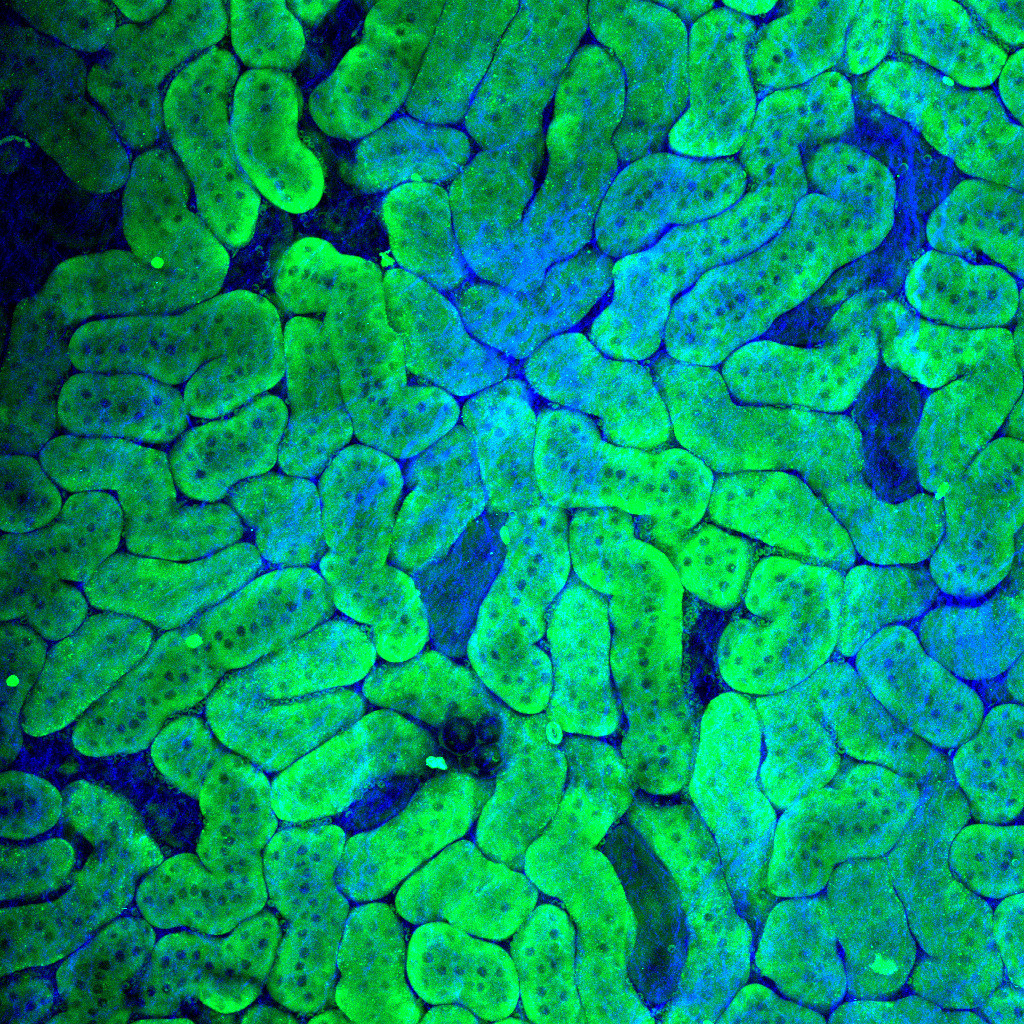
試料:マウス内耳蝸牛管、
生後2日目
染色:Atto-565-phalloidin
試料ご提供:神戸大学大学院医学研究科 分子細胞生物学分野 富樫英先生
受精後34時間のゼブラフィッシュ・トランスジェニック
系統Tg [h2afv:GFP; EF1α : mCherry-CAAX] を用いた3D イメージング。メラニン合成を抑制するフェニルチオ尿素(PTU)下で飼育したゼブラフィッシュの体全体に、透明化剤LUCID-A を用いて処理を施した。この系統では細胞膜をmCherry(赤色)で、クロマチンをGFP(緑色)
で可視化している。
励起波長:900 nm・1040 nm、対物レンズ:CFI75 アポクロマート25XC W 1300 (NA 1.10, WD2.0)
望月俊昭先生、政井一郎先生
撮影ご協力:沖縄科学技術大学院大学 神経発生ユニット
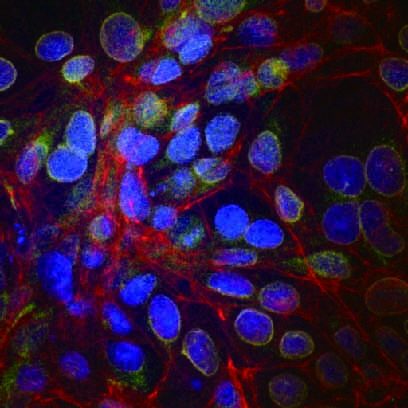
DAP(I 核)、Alexa FluorR 488(ビメンチン)、Alexa FluorR 568(ラミン)、Alexa FluorR
594(チューブリン)、Alexa FluorR 633(アクチン)の5色で多重染色したHeLa 細胞
撮影ご協力:久留米大学医学部 皮膚科学教室 辛島正志先生
2018-07-26T13:28:49 Camera Name:
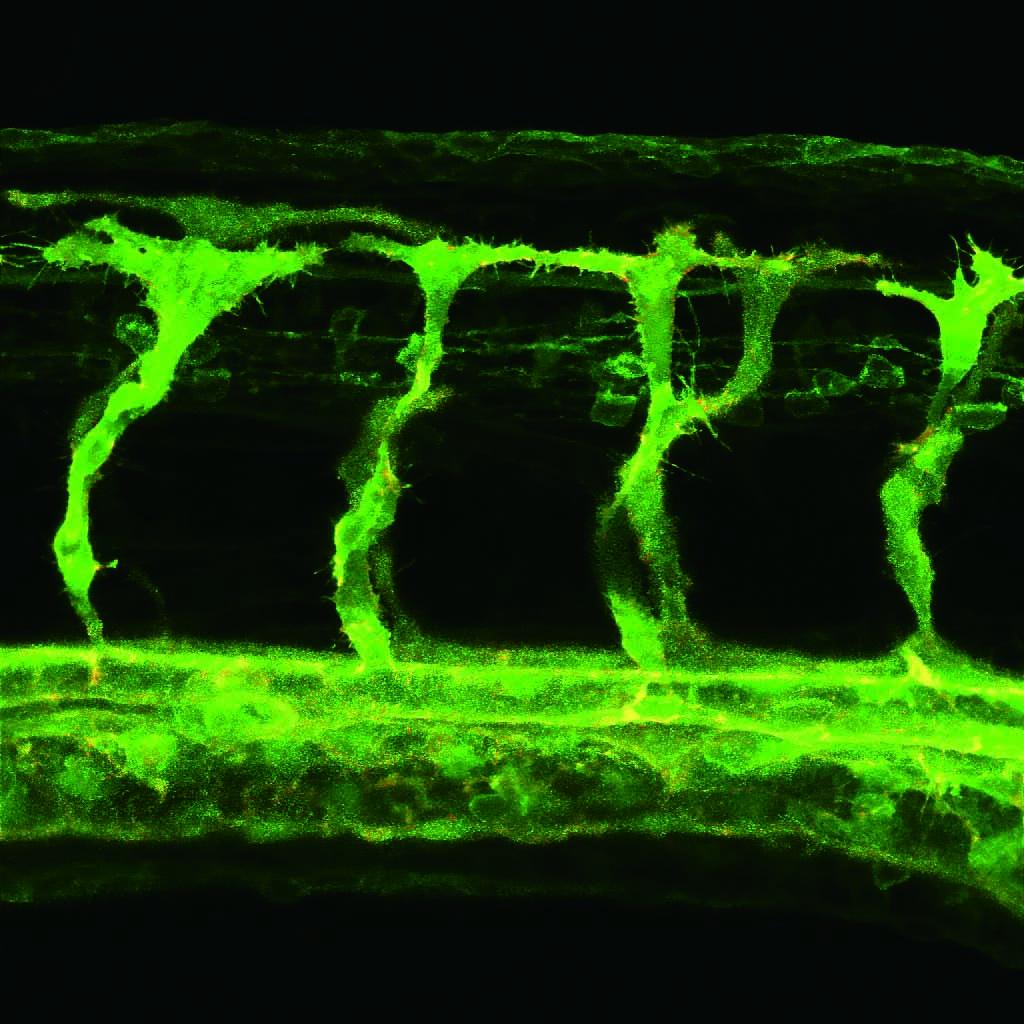
血管内皮細胞のアクチン繊維と細胞膜をmCherryとGFPで可視化したゼブラフィッシュ胚における血管新生のタイムラプスイメージング。受精後22時間から、レゾナントスキャナー(64枚の平均)で、2.5分毎、14時間の3Dタイムラプス撮影を行った。
画素数:1024×1024、ズーム2X、68枚のZスタック画像血管新生過程の内皮細胞における迅速なフィロポディアの形成と退縮が鮮明に可視化されている。
撮影ご協力:日本医科大学先端医学研究所病態解析学部門 弓削進弥先生
2018-08-10T12:06:21
CFIプランアポクロマートLambda 10X対物レンズで取得したマーモセット脳の全体像のタイリング画像と、CFI SR HPプランアポクロマートLambda S 100XC Sil対物レンズで取得した樹状突起スパインの詳細画像(樹状突起のポジション[深さ]により色 分 け )。
2018-08-09T15:18:42 Camera Name: Numerical Aperture: 1.49 Refractive Index: 1.515
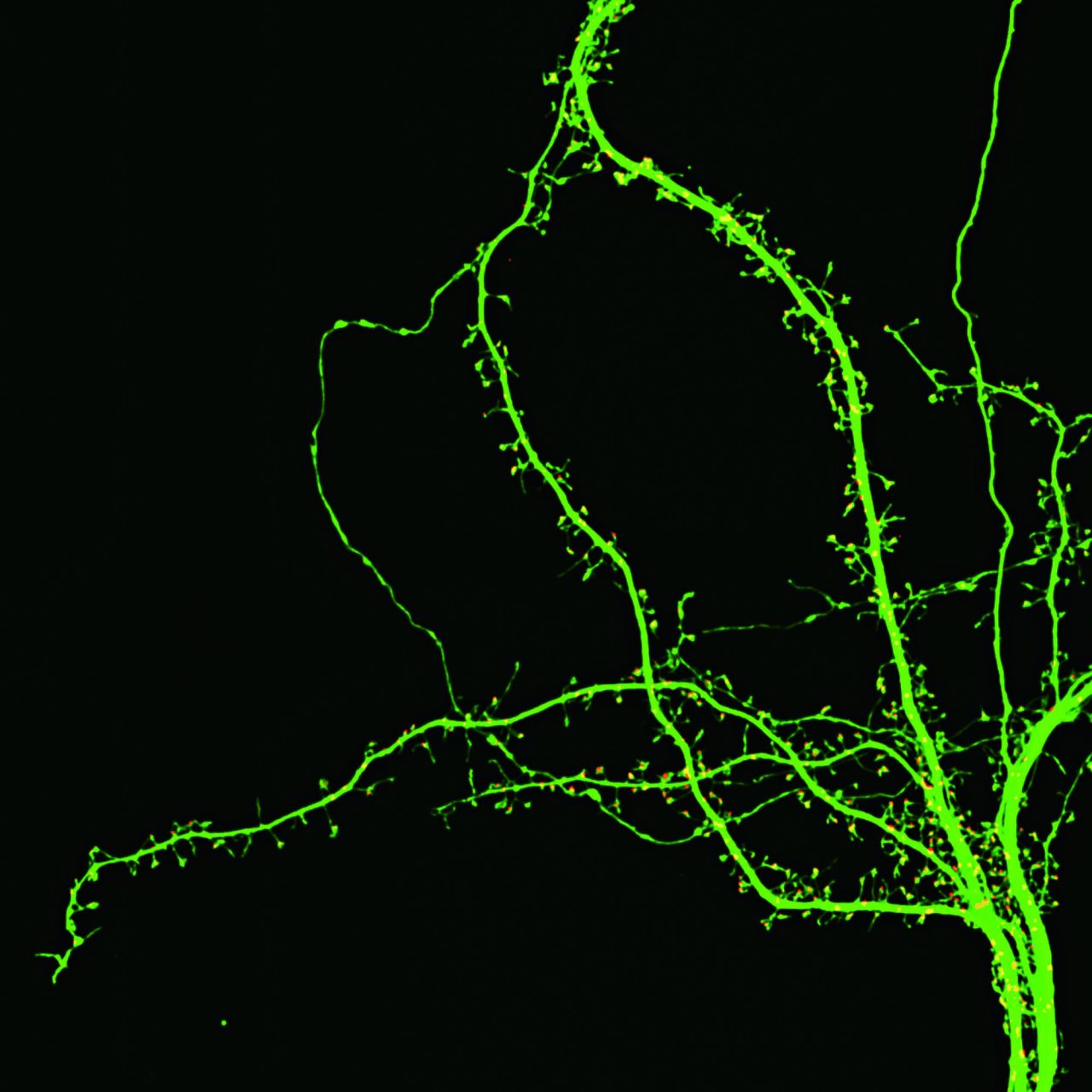
培養後21日のマウス海馬神経細胞、 緑:GFP(樹状突起)、赤:PSD-95-TagRFP (シナプス後部マーカー)
撮影ご協力:東京大学 大学院医学系研究科・医学部 神経細胞生物学分野柏木有太郎先生、岡部繁男先生
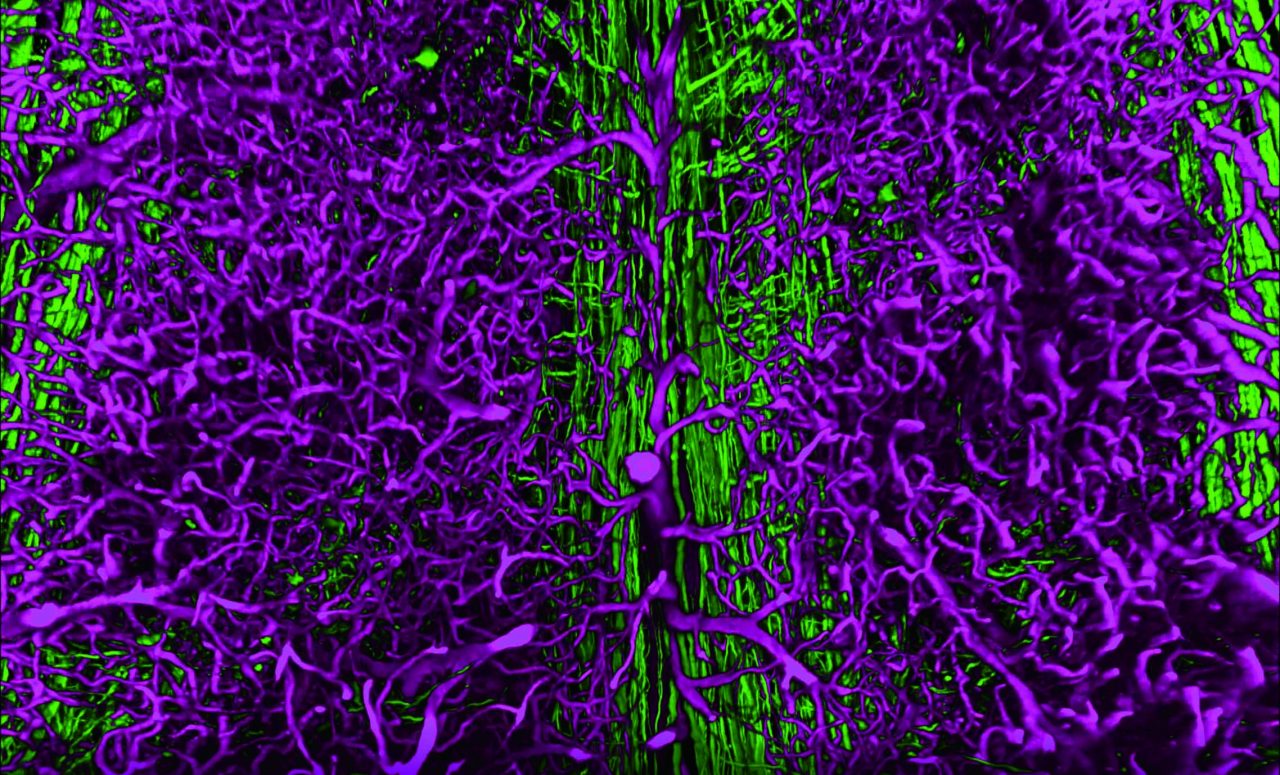
apiClear/SunJin Labで透明化した脊髄の神経回路(緑)と血管(紫)。
対物レンズ:CFI アポクロマートLWD
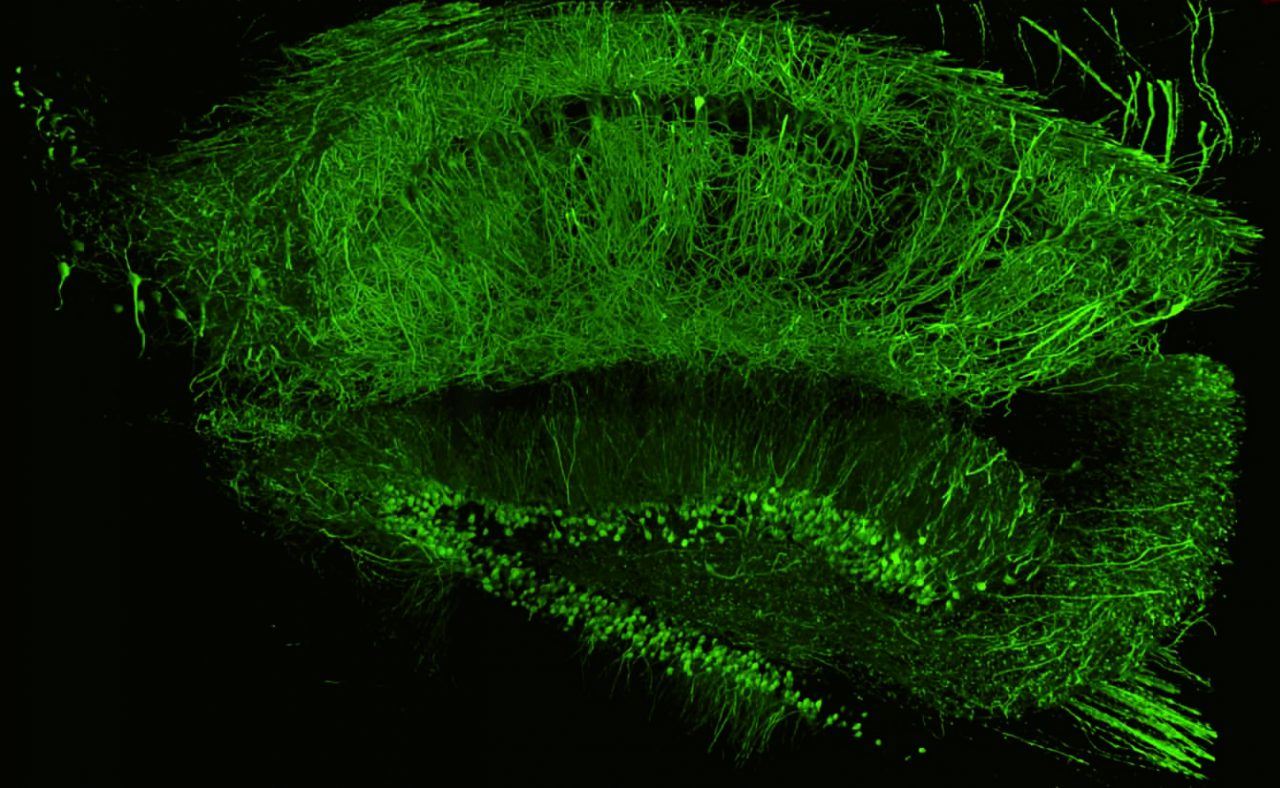
RapiClear/SunJin Labで透明化した海馬の詳細な深部画像。
対物レンズ:CFI アポクロマートLWD La
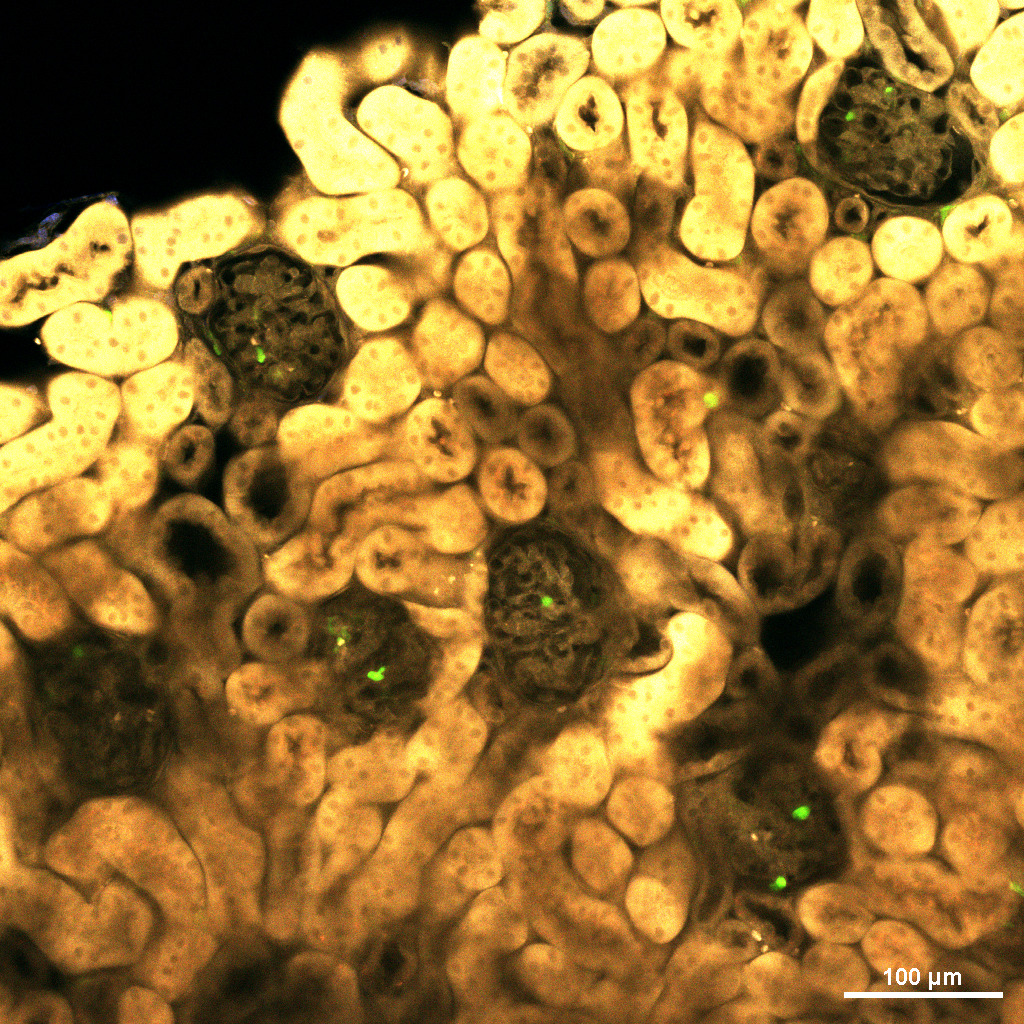
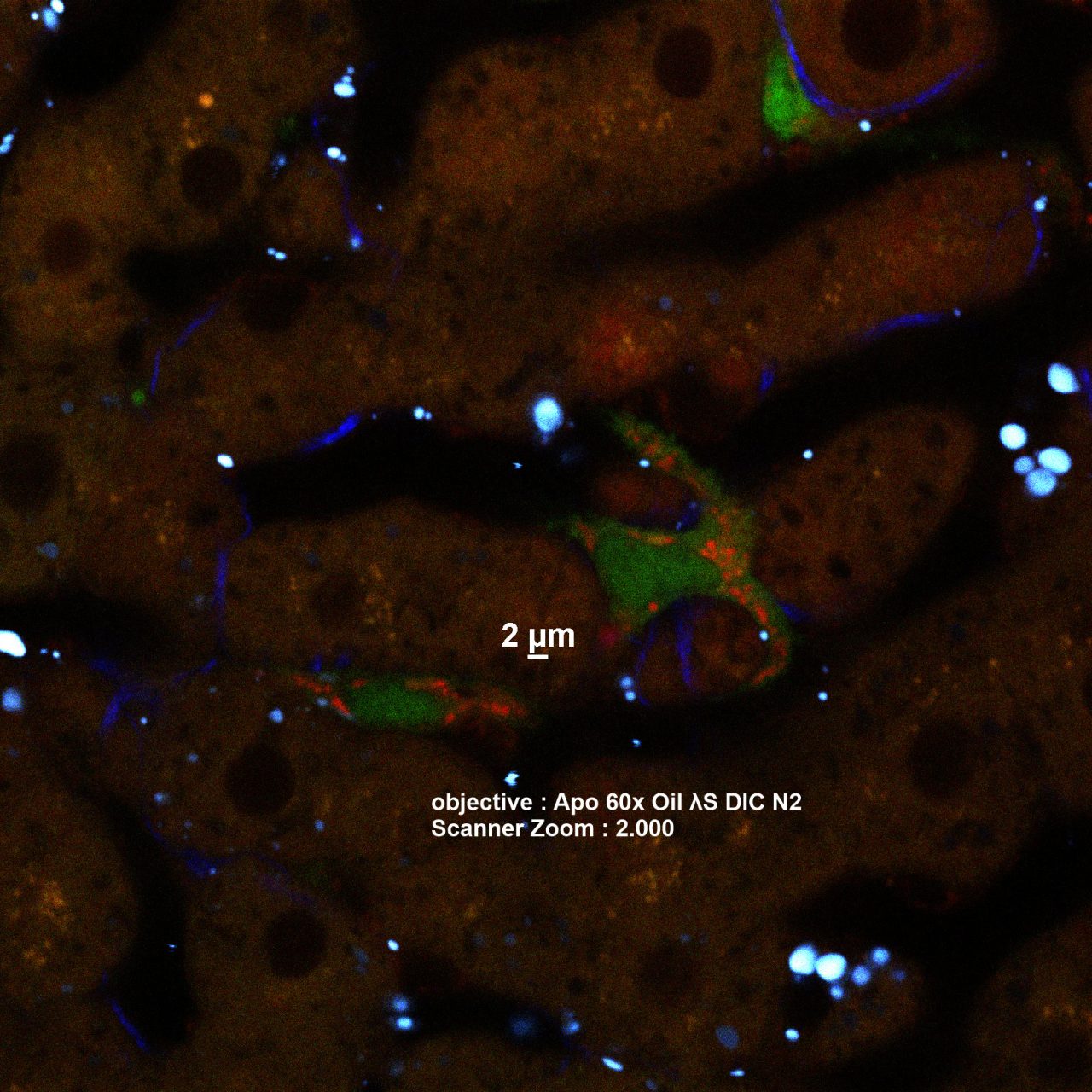
小腸上皮細胞の3 次元培養系であるe n t e r o i dを用いて、carbachol刺激に対するPaneth細胞の顆粒分泌応答を高速
4次元(61ステップのZ画像を1.98 秒/ボリュームで取得、PiezoZステージ、1Kレゾナントスキャナー使用)でライブイメージング。
Paneth細胞の顆粒(緑)が一粒一粒内腔に向かって分泌される自然免疫応答を高精細3次元タイムラプスで取得。
緑:Zinpyr-1(Paneth細胞顆粒)、紫:CellMaskTM Deep Red(細胞膜)
励起波長:488 nm、638 nm 解像度: 1024×512画素
細胞生物科学分野 自然免疫研究室 横井友樹先生、中村公則先生、綾部時芳先生
2017-07-24T14:07:51 Camera Name: Numerical Aperture: 0.5 Refractive Index: 1.47
RapiClear1.52, SunJin Labを用いて透明化したH-lineマウスの2 mm 厚脳切片。脳内微細構造を広視野画像と詳細画像(6Xズーム)で取得。
画素数:1024×1024
撮影ご協力:北海道大学電子科学研究所 光細胞生理研究分野 川上良介先生、大友康平先生、根本知己先生
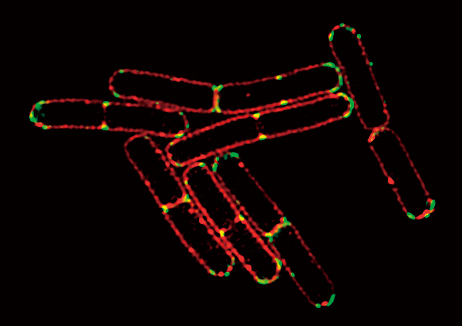
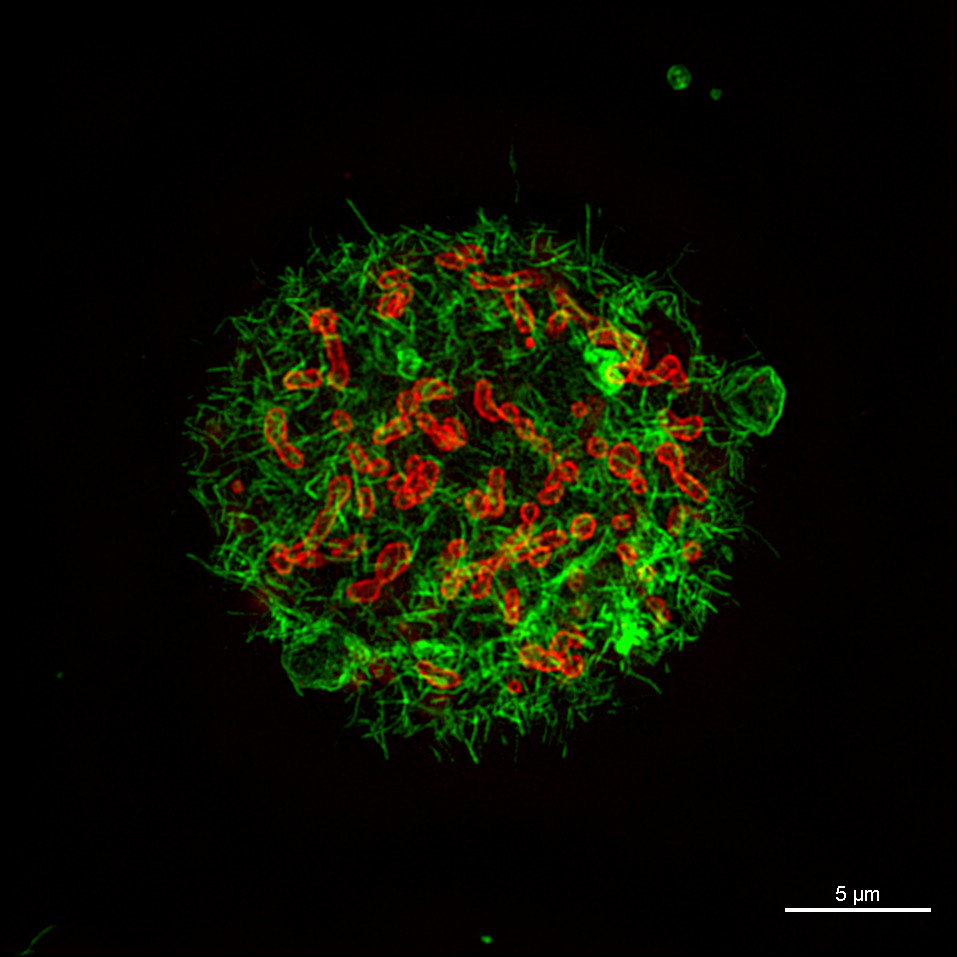
膜色素Nile Red(赤)で染色し、GFP(緑)と融合した細胞分裂タンパク質
DivIVA を発現した枯草菌バクテリア
超解像画像により、細胞分裂中のタンパク質の局在を正確に可視化できます。
画像再構築方法:スライス
撮影ご協力:Drs. Henrik Strahl and Leendert Hamoen, Centre for Bacterial Cell Biology, Newcastle University
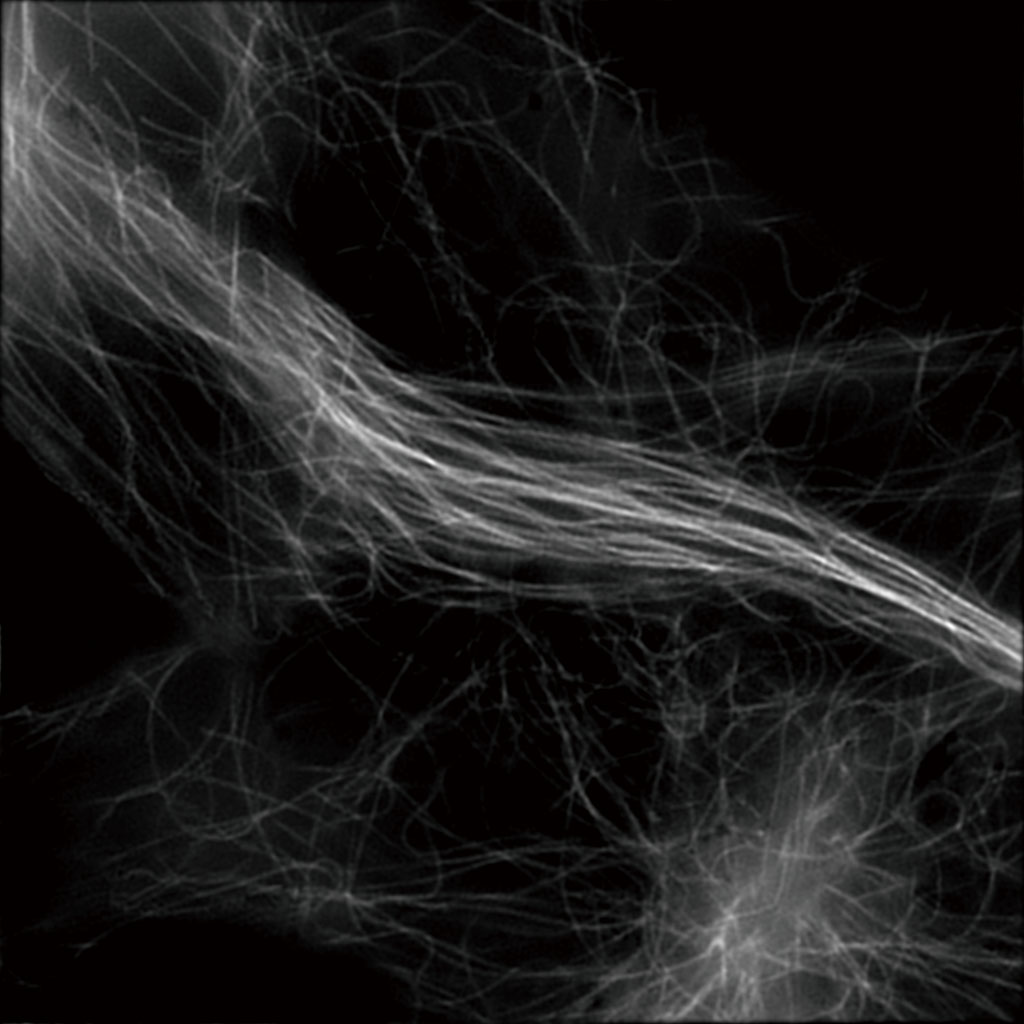
YFP で標識したB16 腫瘍細胞の微小管
対物レンズ:CFI アポクロマート TIRF 100XC Oil (NA 1.49)
取得時間:約1.8 秒/枚(動画)
画像再構築方法:スライス
撮影ご協力:独立行政法人理化学研究所 生命システム研究センター 細胞極性統御研究チーム 岡田康志先生
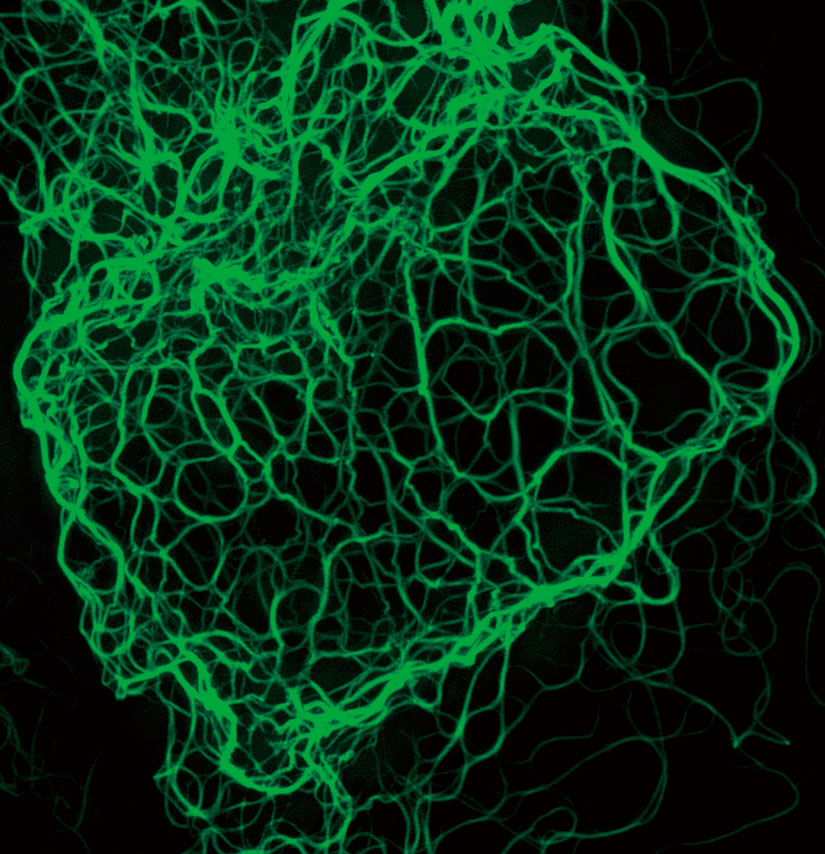
抗ケラチン中間径フィラメント抗体で標識し、Alexa Fluor 488 標識二次抗体で染色
したマウスのケラチン生成細胞
画像再構築方法:スタック
撮影ご協力:Dr. Reinhard Windoffer, RWTH Aachen University
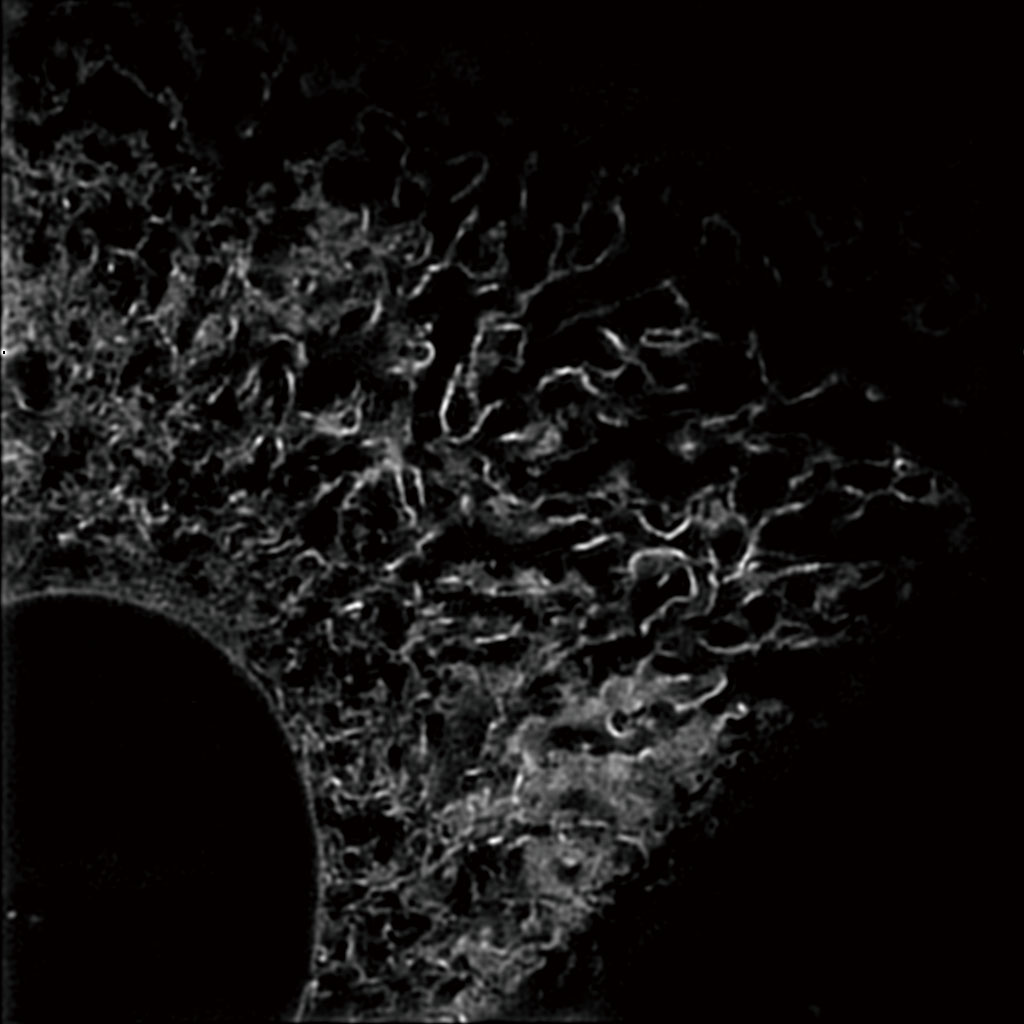
GFP で標識したHeLa 生細胞の小胞体
対物レンズ:CFI アポクロマート TIRF 100XC Oil (NA 1.49)
取得時間:約1.5 秒/枚(動画)
画像再構築方法:スライス
撮影ご協力:福島県立医科大学医学部附属生体情報伝達研究所 和田郁夫先生
Imaris Snapshot
Imaris Snapshot
セミナールーム
美しい顕微鏡写真はこちらのサイトでもご覧いただけます。